
Edu-talk
이매스교육 및 공지사항
Edu-talk
-
제목
[Proteomics] 단백질 서열분석을 위한 분석 장비별 특성 -
작성자
이매스 -
첨부파일
Edman Protein Sequencer
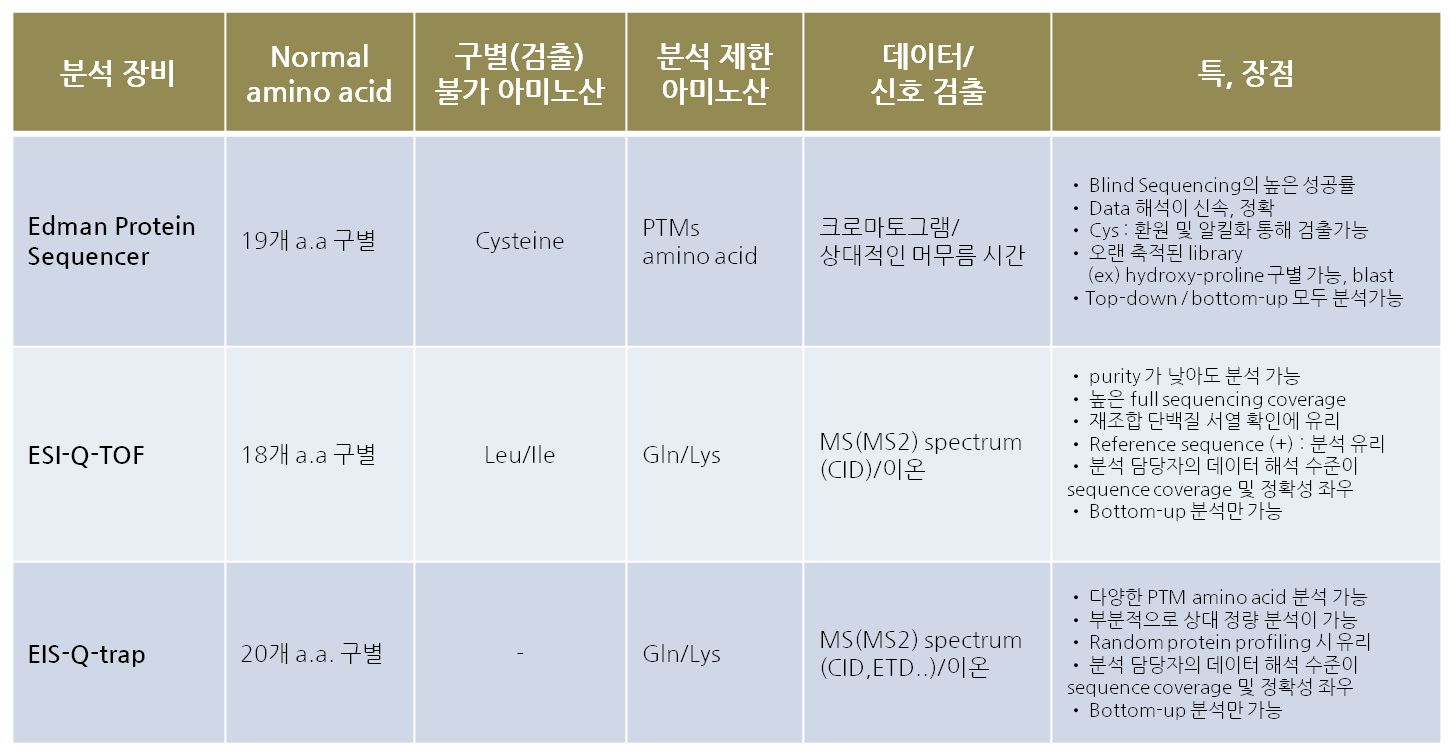
Edman sequencing 분석은 intact 단백질/펩티드의 N 말단으로 부터 순차적으로 아미노산을 분리하여 동일한 PTH 형태의 유도체화를 거쳐 PTH C18 컬럼 내에서 표준 아미노산의 컬럼머무름 시간과 비교분석을 통하여 아미노산을 구별하는 방식으로 서열을 결정한다.
따라서 normal amino acid 중 cysteine 을 제외하고는 모든 아미노산의 신호 검출을 통해 구별이 가능하다, 만약 cysteine 을 정확하게 검출 확인하고자 한다면, 분석 대상 단백질을 환원(reduction)과 알킬화(alkylation) 또는 pyridyethylation 을 거쳐 화학적인 안정된 구조로 변형하면 같은 조건의 크로마토그램 데이터 내에서 신호 검출이 가능하다.
본 장비를 통한 서열 분석의 장점 중 하나가 간단한 형태의 크로마토그램 데이터가 획득되므로 예상서열 정보가 없더라도 정확한 blind sequencing 이 가능하고 분석에 소요기간은 별도의 전처리 없이도 top-down 방식으로 직접 시료 단백질로부터 서열 분석이 가능하므로 데이터 분석에 까지 소요되는 기간이 짧다는 장점이 있다.
분석법이 개발 된 이후부터 오랜 시간 동안 많은 데이터 축적으로 표준 아미노산과 구조가 부분적으로 다른 PTM 아미노산 일부분을 구별할 수 있는 참고 데이터를 보유하고 있다. (예, hydroxyproline, 알킬화된 cysteine, 산화된 tyrosine 등)
단점은, full sequencing 분석의 기기상 해석의 한계로 현재는 재조합 단백질의 발현 후 안정성 확인과 천연 단백질의 부분 blind sequencing 분석에 넓게 활용되며 ESI-LC-MS 를 이용한 sequencing 분석과 상호 보완적으로 활용되고 있다.
ESI-Q-TOF
ESI-Q-TOF 장비를 통한 sequencing 은 low energy CID 방식의 기본 아미노산 이온의 fragment 이온을 N 말단, C 말단 양방향으로 동시에 분석하는 과정으로 sequence 를 결정한다. MS/MS 수준의 이온 신호 검출의 정확성이 뒷받침 되어야 하므로 높은 sequence coverage 를 위해서는 ion-trap 방식에 비하여 정확성이 높다, 단 Leu/Ile 분자량이 동일한 아미노산이나 Gln/Lys 과 같이 10 ppb 이하의 mass 정확성이 요구되는 유사 분자량 구별이 필요한 아미노산의 서열 분석과정은 제한되는 경우가 많다.
하지만, bottom-up 방식으로 접근하여 서열을 동시에 해석하는 데이터를 얻을 수 있으므로 효과적인 분석 진행이 가능하며 시료를 준비하는 조건/데이터 해석 방향에 따라 N-(C-)term sequencing, disulfide-bond 의 위치 결정, protein ID 등 다양한 분석이 가능한 분석 장비이다.
최근에는 재조합 단백질의 proteolysis 에 대한 확인 및 시료 내에 생성된 impurity protein band 의 확인을 진행하는데 높은 활용빈도를 나타낸다.
단점으로는 reference 가 되는 아미노산 서열 정보가 없거나 부족한 경우, 데이터 해석에 있어 전문 분석자의 도움이 필요하고 또한 PTM 아미노산의 낮은 감도 특성으로 인하여 데이터 중간 중간에 loss 가 발생할 수 있는 소지가 있습니다. 그런 문제점을 해결 하기 위해 초기 시작하는 시료의 양과 순도가 본 데이터의 분석을 좌우하게 된다.
최근, 동위원소 등의 별도의 표지를 달지 않고 시료 내 단백질의 정량분석 (label-free protein quantitation) 분석이 트랜드로 떠오르면서 본 장비를 이용한 정량분석 기술 최신 기술로 주목을 받고 있다.
ESI-Q-Trap
ESI-Q-Trap 장비를 통한 sequencing 분석은 기본적으로 ESI-Q-TOF 와 동일한 low energy CID 방식의 기본 아미노산 이온의 fragment 를 얻는 방식을 채택하고 서열분석 방식도 동일하나, ESI-Q-TOF 와 차별되는 추가적인 특징은 CID 를 통한 조각 이온생성 뿐만 아니라, ETD, ECD 등의 다양한 조각 이온 생성과정을 통해 ESI-Q-TOF 장비에서 얻어진 MS/MS spectral data 의 해석의 한계를 극복할 수 있는 점입니다. 특히, 생체 내에서 빈번히 발생되고 검출 되는 Post-translational modification (PTMs) 의 신호 전달의 확인을 일차적인 서열 분석을 통해 학인 하는 과정이 중요한 분석 기술로 이미 자리를 잡은 상태입니다. 따라서 생체 내 단백체의 profiling 및 typing 을 하여 풍부한 데이터를 획득할 수 있는 방법은 ESI-Q-Trap 장비를 활용한 서열 분석 및 생명공학 분야의 정성 정량적인 분석을 통한 신호 전달 체계의 연구 등의 기초 연구 분야에 다양하게 활용이 가능합니다. 단, ESI-Q-TOF 장비에 비하여 시료 별 최적화를 위한 과정이 전문 장비 분석자의 기술적인 노하우에 의존하는 경우가 많기 때문에 안정된 분석을 위해서는 분석자의 기술적인 능력도 중요한 비중을 차지하는 부분이라고 할 수 있다.
